利用小分子催化脱氨实现转录组范围内RNA m6A的图谱绘制
2025年4月17日,芝加哥大学何川(Chuan He)教授团队在Nature Chemistry期刊上发表了题为“Small-molecule-catalysed deamination enables transcriptome-wide profiling of N6-methyladenosine in RNA”的研究成果。
该研究报道了一种基于小分子协同催化 (cooperative catalysis) 的N-亚硝化 (N-nitrosation) 策略、利用温和脱氨方法,成功开发了名为CAM-seq (chemical cooperative catalysis-assisted m6A sequencing) 的新技术,实现了在单碱基分辨率下对RNA上的N6-甲基腺苷(m6A)进行高灵敏度、低背景、低起始量、多物种的全转录组测序。
论文通讯作者是何川教授;王平鸾 (Pingluan Wang)、叶畅 (Chang Ye) 和 Michelle Zhao 为共同第一作者。
RNA的化学修饰,特别是m6A修饰,在基因表达调控、RNA降解、蛋白质翻译等众多关键生物学过程中发挥着重要作用。大量研究表明,m6A修饰异常与多种重大疾病密切相关,包括癌症、神经退行性疾病、代谢紊乱和病毒感染等。因此,精准绘制m6A在转录组中的分布图谱,对于深入解析其生物学功能及其在疾病中的作用机制具有重要意义。近年来,随着表观转录组学技术的飞速发展,多种m6A高通量检测方法相继问世,如MeRIP-seq/m6A-seq、SAC-seq、eTAM-seq、GLORI等。这些技术不断优化,在提高检测灵敏度与分辨率、降低背景噪音及增强定量能力方面取得显著进展,极大地推动了对m6A修饰调控机制及其病理生理相关性的研究。然而,面对更高分辨率、更低输入量、更强通用性及定量精度的需求,现有技术仍存在诸多挑战,亟需新一代更高效、精准且适用于复杂生物样本的检测方法。
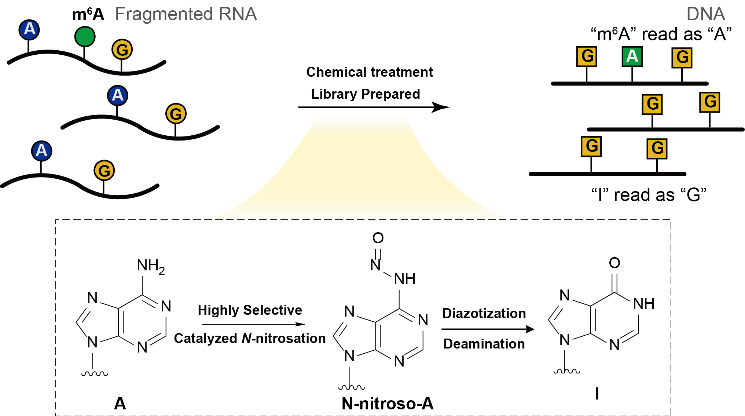
图1:CAM-seq测量转录组m6A的原理。
在这项工作中,何川团队受到早期羰基催化N-亚硝化反应的启发,创新性地引入路易斯酸 (Lewis acid) 协同催化策略,在温和条件下实现了RNA中腺嘌呤(A)的选择性脱氨,生成生成次黄嘌呤(I)。团队系统探索了该协同催化反应的机制:在Lewis酸作用下,腺嘌呤与有机羰基催化剂发生缩合并脱水,生成亚胺中间体,显著降低亚胺羰基碳上的HOMO轨道能级,从而促进亚硝酸根离子的亲核加成。随后,该加成中间体经历重排,形成N-亚硝化产物。通过一系列“缩合–脱水–加成–重排”的串联催化步骤,串联重氮化、脱氮策略,温和而高效地将A转化为I,而m6A修饰位点因其甲基降低反应性,同时阻断后续重氮化、脱氮,在此条件下保持稳定,避免脱氨反应。在随后的逆转录过程中,A-to-I转化在测序中表现为A-to-G突变,而m6A修饰位点仍与T碱基正常配对,未发生突变。借助这一反应特异性,该方法实现了对m6A修饰位点的单碱基分辨率识别,构建了一种全化学、精准、通用性强的m6A检测新技术。
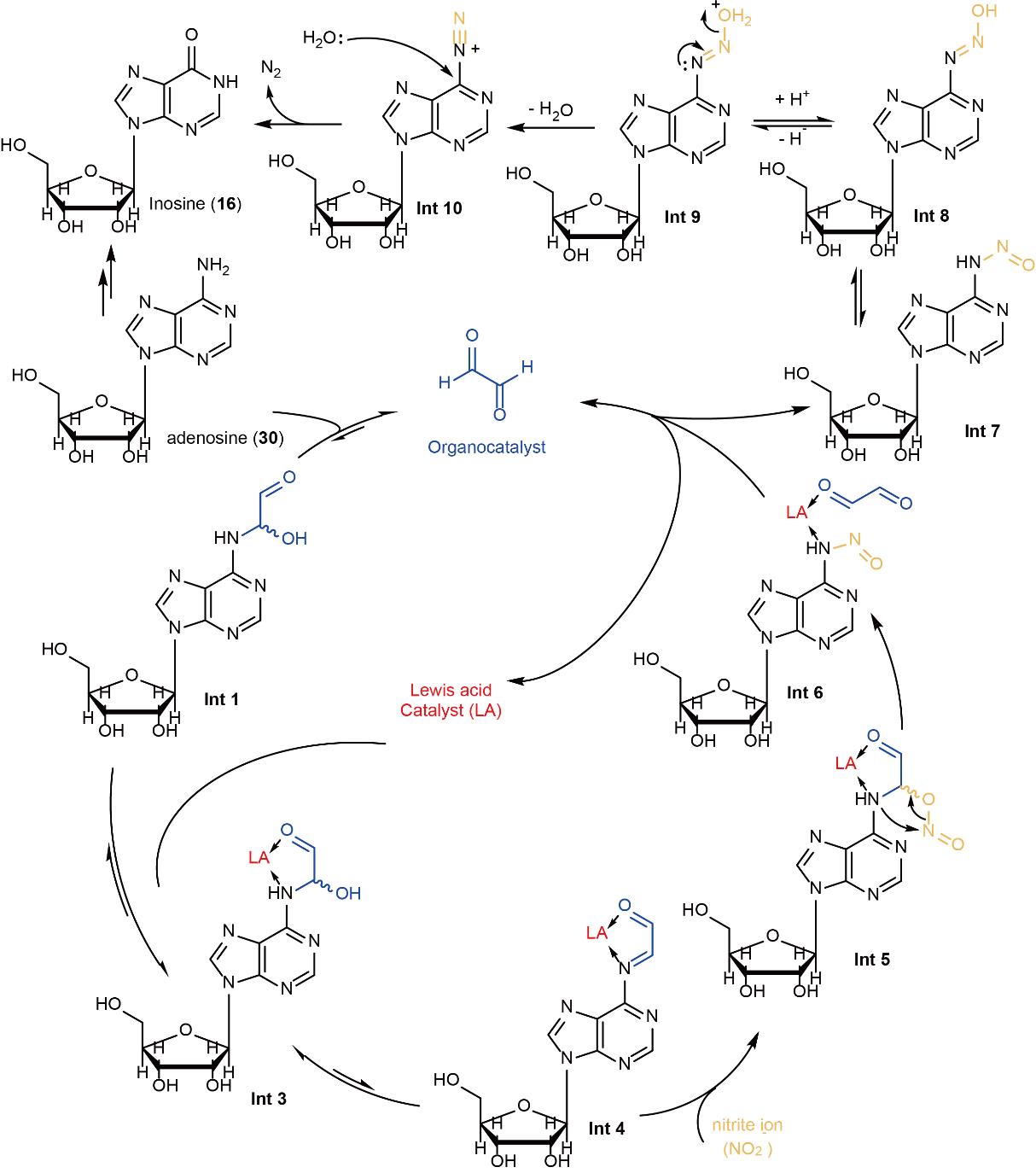
图2:小分子催化剂-Lewis酸协同催化脱氨反应机理探索。
利用CAM-seq技术,研究团队仅需10纳克(ng)的polyA富集RNA作为起始样本,便成功绘制了人类HEK293T细胞以及模式植物拟南芥和玉米中 m6A 修饰的高精度图谱。分析确认,m6A 主要富集于经典的RAC(R=G/A)核心序列,而在普遍认为缺乏 m6A 的序列(如UAG)上检测到的背景信号极低(低于0.1%),凸显了该方法的特异性。研究还揭示,在植物中,与RAC序列相似的YAC (Y=C/U) 和RAU (R=G/A) 等序列也存在显著修饰。此外,通过跨物种比较分析了 m6A 修饰序列的偏好性差异,并利用重要性评分(Importance score)量化了 m6A 位点侧翼碱基序列对其修饰效率的影响。
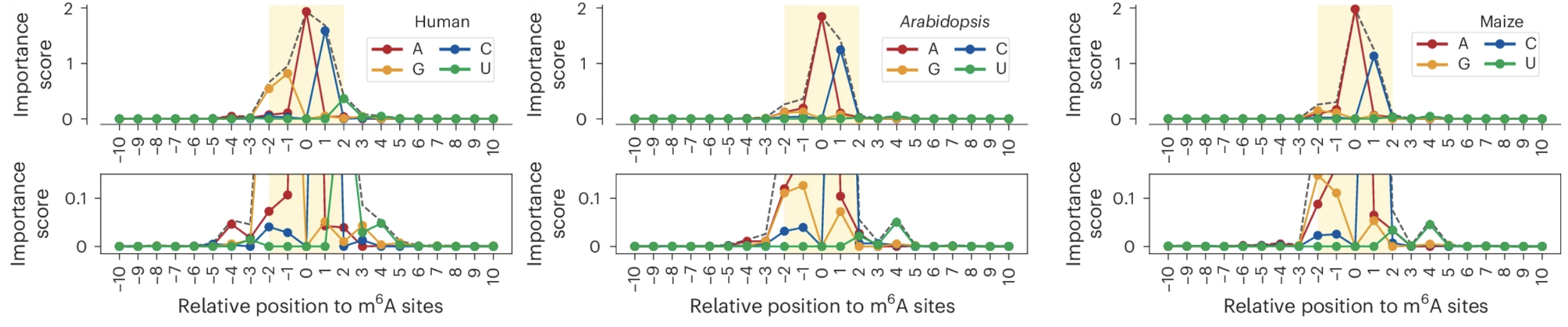
图3:多物种m6A修饰的差异。
这种高精度的深度测序实现了近乎饱和的检测,例如,在HEK293T细胞中就识别了高达282,281个高置信度的 m6A 位点 (P<0.001),充分体现了该方法的覆盖广度与深度。基于这一前所未有的饱和 m6A 图谱,研究者得以深入探究基因层面的调控规律。他们创新性地发现,依据每个基因内 m6A 的“最大修饰水平”,可以将所有经 m6A 修饰的基因清晰地划分为两类:一类整体修饰水平偏低,另一类则具有高修饰潜力。进一步分析表明,这两类基因的 m6A 整体水平均与其基因表达水平呈现显著的负相关。
总而言之,CAM-seq技术有效克服了现有 m6A 测序方法的诸多瓶颈,为 m6A 研究领域提供了一种起始样本量低、操作流程简化、成本效益高、背景噪音极低且真正定量的强大分析工具。该技术能够实现对转录组 m6A 修饰的全面、精准分析,将有力推动我们对 m6A 在各种生物学进程中的动态调控机制及其功能重要性的深入理解。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s41557-025-01801-3
